1 ヒ素と人類の歴史
ヒ素化合物は100年以上前から殺鼠剤、殺虫剤、顔料(やや黄色味を帯びた明るい緑色)、農薬、染料として用いられてきました[1]。医薬品としては非常に古い歴史があり、ヒポクラテスの時代(BC400年)に潰瘍の治療薬、脱毛薬として使用されました。中国では感染巣に対する治療薬として活用されました。同じころから、投与量が多いと中毒症状が出現したという記載もあります。紀元前の時代においても、少量では薬、大量では毒物という法則が合致した物質と言えます(現在の西洋医学の薬も同じです)。
近年に入ってからは、17世紀以降数百年に渡り美肌をもたらす薬剤として利用されてきました。三酸化二砒素を肌に塗ると皮膚表層の血管を障害し、頬が染まる効果、その後白味を帯びる効果があり、これらの効果が美肌のために重宝されました。1960年台には、特定の白血病に亜ヒ素が効果を持つことが認識され、1999年には急性前骨髄性白血病の治療薬の一つとして報告[2]されています。
毒物としては、1955年には粉ミルクにヒ素が混入する森永砒素ミルク事件が起き、多くの乳幼児に中枢神経障害を伴う後遺症をもたらしました[3]。ヒ素は通常無味・無臭であることから、食べ物に混入しても気づくことは困難です。1998年に発生した和歌山カレーヒ素事件はそのような特徴も考慮されたと考えられています。仮に、多少臭いがあったとしてもカレーの中への混入では気づくことはほぼ不可能ですが。
2 ヒ素曝露機会の増加
地球上では、人口の急速な増加が生じてきています。1987年に50億人だった人口は2011年には70億人となり、2022年11月には80億人に達するとされています。飲料水確保のための地下水汲み上げが盛んとなり、特に東南アジア(インド、バングラデシュ、ミャンマーなど)において、当初は浅い井戸、1980年台からは数百mを超える深い井戸が開発され、それに伴いヒ素を含む重金属曝露地域が広がっています[4]。同時にレアメタルの確保のために地中深くの地層の開発により、本来地上とは縁のない重金属が地上に掘り起こされています。人類の活動とは別に、硫黄山の事例のような火山の噴火により地中に眠っていた重金属が地表にでることもあります。これらの原因により、ヒトが許容できる閾値をはるかに超える量の重金属がヒトに接する機会が激増しています。
毒性が強いために特に問題となっているヒ素中毒に関して、50か国以上の国で1億4千万人以上が汚染された飲料水を飲んでいると見積もられています。しかしながら、その症状については先進国での砒素汚染例は少数の急性中毒例が検討されているのみで、慢性砒素中毒による神経障害とは何かということ自体が討論されているに留まっています。慢性砒素中毒症状とその経過については不明な点が多く、世界各地における慢性砒素中毒患者の診療は手探りの状態が続いています。また、慢性砒素中毒症状とその長期・短期経過はどうなっているのか、ということは解明されていません。
3 ヒ素の代謝経路と毒性の変化
地球上には水や土壌の中にヒ素が広く分布しています。ヒ素には、有機ヒ素と無機ヒ素の両者が存在し、両者とも3価と5価の状態で存在可能です。通常は5価のヒ素として存在しますが、深い井戸や深い位置の海水では3価で存在します。海水のヒ素濃度は2 ppb前後で、雨や川の濃度はほぼ0 ppbです。
ヒ素の形態により組織に対する毒性が異なります。ヒトや動物における無機ヒ素の代謝経路は正確には解明されていませんが、おおよそ下図のように考えられています[5]。赤字は相対的な毒性を示しており、3価のヒ素の毒性が強いことがわかります。
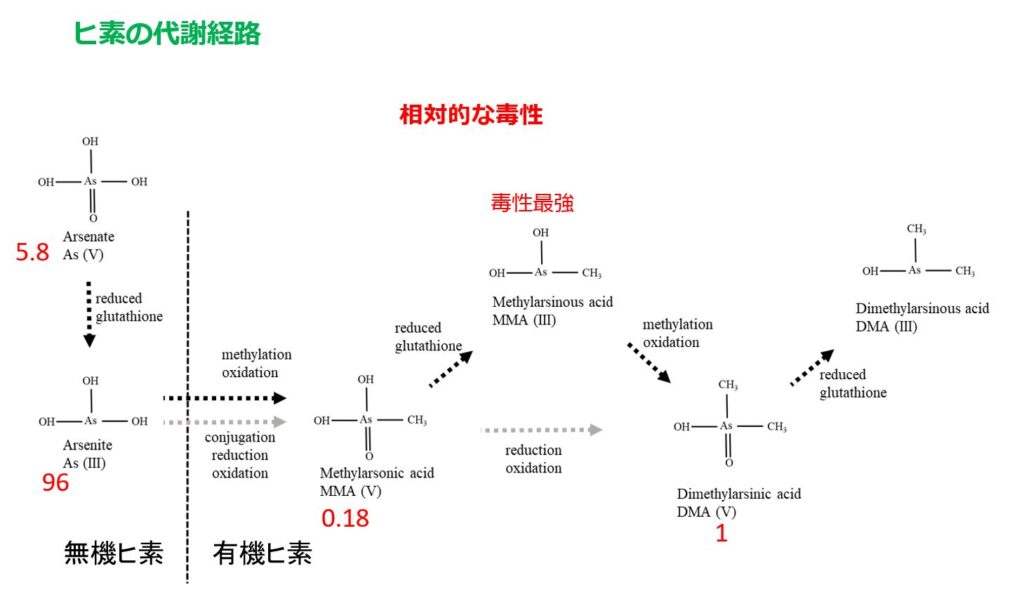
ヒトにおいて、無機ヒ素の体内取り込みは 60-87%とされ、最終的には尿と便に排泄されます。体内での半減期は約4日でその形態により変化します。無機ヒ素はほぼ上記の代謝経路に沿って代謝されますが、有機ヒ素の場合は全く異なる代謝経路をとり、障害される臓器も異なります。例えば、茨木県神栖市での旧日本軍の遺物からジフェニルアルシン酸(有機ヒ素)が地下水に漏出した事例[6]では、中枢神経系の障害がメインで、末梢神経や皮膚には明らかな障害は認めませんでした。
4 ヒ素曝露量とその障害との関係
無機ヒ素摂取量と皮膚疾患、内臓癌の発症、心臓血管および脳血管障害、肝臓障害においては、有意なdose-response relationshipが存在します。曝露量と疾患の発症率が相関関係にあるということです。皮膚疾患に関しては、角化症、色素沈着などの皮膚症状は飲料水ヒ素濃度が5-10 ppb以上で生じうることが報告[7]されています。WHOのヒ素飲料水濃度の基準が10 ppb[8]なので、この基準よりも低い濃度でも皮膚症状は生じる可能性があります。
肺癌、膀胱癌、腎癌に関しては複数の報告があり、いずれも飲料水ヒ素濃度上昇と発癌率上昇の関係が報告されています[9, 10]。米国の1,185人の検討では、10 ppb以上のヒ素飲料水摂取群にて心臓血管系の問題が有意に高かったことが示されています[11]。肝障害に関しては、34 ppb以上のヒ素飲料水摂取群で肝臓機能酵素の上昇が報告されています[12]。
神経系に対するヒ素の障害は、末梢神経系と中枢神経系に対する障害に分類されますが、曝露量との関係についての分析は少数のみです。末梢神経系においては、温痛覚を司る小径線維と振動覚・位置覚を司る大径線維がありますが、小径線維が優位に障害されやすいと推測されています[7, 13-15]。
中枢神経系の障害については、血液脳関門の存在により障害が生じにくいとされます。脳幹機能障害を検出する聴性脳幹誘発電位では正常群との有意差がありません[16]が、大脳白質機能を鋭敏に評価できる体性感覚誘発電位では、高濃度曝露群においては長期間に渡り大脳白質の伝導遅延が認められました[17]。
5 小児への影響
毒物が小児の脳に悪い影響を及ぼすかどうかについては、結論がまだありません。末梢神経、肝臓などの臓器は障害されても再生することが期待できますが、中枢神経は回復することが見込みにくい臓器であり、特に小児においては影響の有無は甚大です。
疫学的に低濃度ヒ素汚染が小児の高次機能障害をもたらすという研究結果があります[18-20]。一方で、West Bengalの報告では長期間の曝露でも高次機能障害には関連しなかったという報告もあります[21]。子供は大人に比較して、“血液脳関門などの毒物からの防御システムが未熟で障害が生じやすいという要素”と“大人と比較して毒物の代謝速度が異なるという要素”があり、飲料水の基準値を作成する際は、大人と同じでよいかどうかは慎重に検討するべきです。
6 曝露経路・量・障害臓器
ヒ素によるヒトへの影響を考える上で、曝露する経路、その量、そして障害される臓器により障害される程度は大きく異なります。例えば、宮崎県土呂久地区でのヒ素曝露経路は、経気道、経口、経皮膚の複数経路が想定されていました。特徴的な症状である鼻中隔穿孔は非常に高濃度なヒ素に経気道的に直接曝露された旧鉱山従事者に限定された症状とされます[22]。粘膜症状の多くも直接曝露による症状と推測されますが、臭覚障害は直接曝露のみではなく間接的な曝露も影響しています[22]。血液脳関門に守られる中枢神経[23, 24]は、高濃度曝露であれば障害を呈しますが、低濃度曝露であれば長期間曝露であっても障害は生じにくいと推測されています。
障害される臓器では、上記にも記載したように末梢神経や肝臓のように再生が期待できる臓器と中枢神経のように再生が難しい臓器があり、長期的な後遺症が臓器により大きな差が生じます。また、遺伝子レベルでは発癌に対する影響は長期間にわたる可能性が懸念され、評価すること自体が困難です。
7 最後に
ヒ素汚染された飲料水の地球上で非常に幅広く、多くの人間に影響する問題ですが、過去の動物実験の結果はヒトにそのままは応用できません。曝露されるヒトの状態、曝露経路、濃度、期間により、障害部位とその程度が異なると推測されます。また、重金属曝露される場合は、複数の重金属が関与する場合もあります。科学的根拠を示すには慎重さが必須です。しかしながら、逆に慎重過ぎると重大な重金属曝露の発見を遅らせてしまう可能性もあります。因果関係を追究するには疫学的なアプローチが必須です。
ヒ素による影響をいろいろと考察しましたが、結局は100年後、1000年後にも住みよい地球を残していきたいと思っています!
文献
1. Hughes MF, Beck BD, Chen Y, et al. Arsenic exposure and toxicology: a historical perspective. Toxicol Sci 2011;123:305-32.
2. Niu C, Yan H, Yu T, et al. Studies on treatment of acute promyelocytic leukemia with arsenic trioxide: remission induction, follow-up, and molecular monitoring in 11 newly diagnosed and 47 relapsed acute promyelocytic leukemia patients. Blood 1999;94:3315-24.
3. Yorifuji T, Kato T, Ohta H, et al. Neurological and neuropsychological functions in adults with a history of developmental arsenic poisoning from contaminated milk powder. Neurotoxicol Teratol 2016;53:75-80.
4. Singh R, Singh S, Parihar P, et al. Arsenic contamination, consequences and remediation techniques: a review. Ecotoxicol Environ Saf 2015;112:247-70.
5. Mochizuki H. Arsenic Neurotoxicity in Humans. Int J Mol Sci 2019;20.
6. Ishii K, Tamaoka A, Otsuka F, et al. Diphenylarsinic acid poisoning from chemical weapons in Kamisu, Japan. Ann Neurol 2004;56:741-5.
7. Ishii N, Mochizuki H, Ebihara Y, et al. Clinical Symptoms, Neurological Signs, and Electrophysiological Findings in Surviving Residents with Probable Arsenic Exposure in Toroku, Japan. Arch Environ Contam Toxicol 2018;75:521-529.
8. WHO. Guidelines for Drinking-water Quality (fourth ed.). World Health Organization, 2011.
9. Lubin JH, Pottern LM, Stone BJ, et al. Respiratory cancer in a cohort of copper smelter workers: results from more than 50 years of follow-up. Am J Epidemiol 2000;151:554-65.
10. Yoshida T, Yamauchi H, Fan Sun G. Chronic health effects in people exposed to arsenic via the drinking water: dose-response relationships in review. Toxicol Appl Pharmacol 2004;198:243-52.
11. Zierold KM, Knobeloch L, Anderson H. Prevalence of chronic diseases in adults exposed to arsenic-contaminated drinking water. Am J Public Health 2004;94:1936-7.
12. Islam K, Haque A, Karim R, et al. Dose-response relationship between arsenic exposure and the serum enzymes for liver function tests in the individuals exposed to arsenic: a cross sectional study in Bangladesh. Environ Health 2011;10:64.
13. Fujino Y, Guo X, Shirane K, et al. Arsenic in drinking water and peripheral nerve conduction velocity among residents of a chronically arsenic-affected area in Inner Mongolia. J Epidemiol 2006;16:207-13.
14. Guha Mazumder D, Dasgupta UB. Chronic arsenic toxicity: studies in West Bengal, India. Kaohsiung J Med Sci 2011;27:360-70.
15. Mukherjee SC, Rahman MM, Chowdhury UK, et al. Neuropathy in arsenic toxicity from groundwater arsenic contamination in West Bengal, India. J Environ Sci Health A Tox Hazard Subst Environ Eng 2003;38:165-83.
16. Ishii N, Mochizuki H, Yamashita M, et al. Auditory brainstem response analysis for long-term central auditory function sequelae in patients with chronic arsenic intoxication: A cross-sectional study. J Neurol Sci 2019;398:2-3.
17. Mochizuki H, Yagi K, Tsuruta K, et al. Prolonged central sensory conduction time in patients with chronic arsenic exposure. J Neurol Sci 2016;361:39-42.
18. Tolins M, Ruchirawat M, Landrigan P. The developmental neurotoxicity of arsenic: cognitive and behavioral consequences of early life exposure. Ann Glob Health 2014;80:303-14.
19. Wasserman GA, Liu X, Parvez F, et al. Water arsenic exposure and intellectual function in 6-year-old children in Araihazar, Bangladesh. Environ Health Perspect 2007;115:285-9.
20. Vibol S, Hashim JH, Sarmani S. Neurobehavioral effects of arsenic exposure among secondary school children in the Kandal Province, Cambodia. Environ Res 2015;137:329-37.
21. von Ehrenstein OS, Poddar S, Yuan Y, et al. Children’s intellectual function in relation to arsenic exposure. Epidemiology 2007;18:44-51.
22. 堀田宣之, 原田正純, 服部陵子, et al. 土呂久鉱毒病(慢性砒素中毒症)の臨床的研究. 体質医学研究所報告別刷.
23. Kiguchi T, Yoshino Y, Yuan B, et al. Speciation of arsenic trioxide penetrates into cerebrospinal fluid in patients with acute promyelocytic leukemia. Leuk Res 2010;34:403-5.
24. Dang HS, Jaiswal DD, Somasundaram S. Distribution of arsenic in human tissues and milk. Sci Total Environ 1983;29:171-5.


